检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
急性T淋巴细胞白血病(T-ALL)是T细胞前体细胞突变积累所产生的恶性血液肿瘤,20%的儿童和40%的成人患者治疗后复发并死于这种疾病。白血病干细胞(LSC)能够自我更新并分化为白血病细胞,是T-ALL耐药及复发的主要原因。然而目前对于T-ALLLSC的干性产生与维持的分子机制仍不明确。
利用抑癌基因PTEN敲除的T-ALL小鼠模型,吴虹课题组前期工作发现PTEN缺失或PI3K信号通路激活所导致的β-catenin活化及Tcra/d-Myc易位在T-ALL的发生和发展过程中起至关重要的作用,并鉴定出LSC富集的Lin-CD3+KITmid亚群。2018年11月9日,吴虹课题组在Elife杂志在线发表了题为“T-ALL leukemia stem cell `stemness` is epigenetically controlled by the master regulator SPI1”的研究论文,揭示了受甲基化调控的SPI1核心转录因子和SPI1-β-catenin-HAVCR2正反馈信号调控环路对于LSC的干性产生与维持的关键作用。尤为重要的是,该调控环路一经形成将不依赖于T-ALL发生和发展过程中起至关重要的作用的PI3K信号通路,而抑制该调控环路任意一个节点都会抑制LSC的形成或减少已生成的LSC。类似的调节机制很可能也存在于T-ALL病人中。该研究鉴定出SPI1是LSC的关键调控因子,并发现LSC分化为白血病细胞是受表观遗传调控的可逆过程,这为了解T-ALL的耐药及复发过程及靶向LSC治疗都提供了依据。
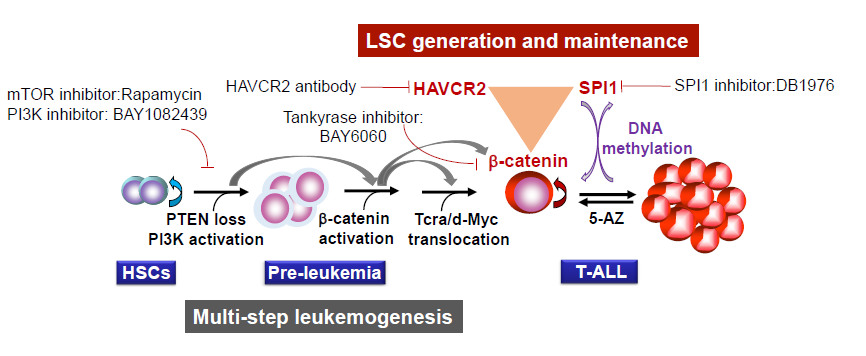
图1. T-ALL形成过程中的分子事件和LSC的干性维持机制
博士生祝海川(CLS 14级)为该论文第一作者。bat365中文官网登录入口、北京未来基因诊断高精尖创新中心(ICG)、北大-清华生命科学联合中心吴虹教授为该论文通讯作者。北京大学化学院雷晓光教授课题组为该项目合作者。该研究项目得到了北京未来基因诊断高精尖创新中心、北大-清华生命科学联合中心及德国拜耳公司的基金支持和资助。