检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2024年5月1日,bat365中文官网登录入口邓宏魁课题组和李程课题组合作在Cell Stem Cell期刊发表题为Remodeling ceramide homeostasis promotes functional maturation of human pluripotent stem cell-derived β cells的研究论文。该研究解析了人多能干细胞衍生的胰岛素分泌细胞(胰岛β细胞)功能成熟的过程,阐述了胰岛β细胞功能成熟的调控模式;在此基础上,通过靶向调控胰岛β细胞成熟的因子,研究团队预测了一个小分子化合物库,经过筛选发现HDAC抑制剂TH34有效促进胰岛β细胞的体外功能成熟。

糖尿病是一种严重威胁人类健康的疾病。对于胰岛素依赖型糖尿病患者,目前常用的外源胰岛素注射难以实现对血糖的精确调控,这导致多种并发症的发生,并严重影响患者的生活质量。临床胰岛移植可以使患者完全摆脱胰岛素注射,实现疾病的治愈。但人原代胰岛组织的稀缺导致胰岛移植的应用受到了极大的限制。人多能干细胞具备在体外稳定的自我更新能力和向人体各种细胞分化的潜能,是体外大量制备人体细胞的理想种子细胞。然而,人多能干细胞分化的功能细胞普遍面临细胞功能不成熟、细胞状态类似于胚胎发育期的问题,这种不成熟性限制了人多能干细胞衍生的功能细胞的体内和体外应用。因此,如何在体外获得功能成熟的人体细胞,是多能干细胞分化领域面临的一个重要科学问题。
由于人体组织样本的稀缺,得到发育后期人体组织用于连续的发育生物学研究极为困难,这导致在细胞命运决定后研究人体细胞功能的成熟过程,一直缺乏有效的模型。前期研究发现,把不成熟的胰岛细胞移植到小鼠体内,它们会在体内微环境的作用下逐渐获得成熟的细胞功能。受到这一结果启发,本研究团队将人多能干细胞分化的胰岛细胞移植到免疫缺陷小鼠体内,借助单细胞多组学测序技术,分析了移植的人胰岛细胞在体内的变化过程。结果显示,移植后的胰岛β细胞基因表达特征和细胞功能逐渐从胚胎发育期转变为青少年/成人期,期间,大部分基因呈现表达水平下调的趋势。对下调表达基因的变化模式和基因功能进一步分析提示,脂代谢在胰岛β细胞成熟过程可能被重塑。
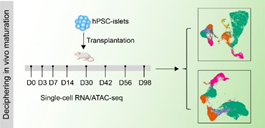
图1,单细胞RNA/ATAC测序解析人多能干细胞衍生胰岛β细胞在体内的成熟过程。
而后,研究团队通过靶向单细胞多组学分析中找到的参与胰岛β细胞功能成熟的调控因子,预测了一个化学小分子库,通过体外的功能筛选发现HDAC抑制剂TH34能够显著改善体外分化获得的胰岛β细胞的功能成熟性,这些改善包括葡萄糖响应性的胰岛素分泌水平、成熟胰岛素颗粒的数量、线粒体氧化呼吸能力等。更为重要的是,TH34处理后的人多能干细胞衍生胰岛细胞移植能够在更短的时间内逆转小鼠糖尿病。进一步的机理解析显示,TH34主要通过调节神经酰胺代谢稳态促进胰岛β细胞功能成熟。
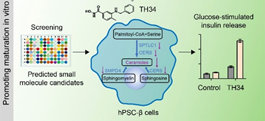
图2,小分子化合物筛选发现HDAC抑制剂TH34通过调节神经酰胺代谢促进人多能干细胞衍生胰岛β细胞功能成熟。
北京大学邓宏魁课题组在人多能干细胞向胰岛细胞定向分化方向有多年的研究基础。2005年,其实验室建立了全球首个分步诱导的方法,将小鼠多能干细胞定向分化为胰岛β细胞(Shi et al., Stem Cells, 2005)。2007年,其实验室建立了首个化学成分明确的人胰岛定向分化方案(Jiang et al., Cell Res, 2007)。而后,又不断优化了人多能干细胞和猴多能干细胞诱导分化为胰岛β细胞的方案(Zhang et al., Cell Res, 2009;Jiang et al., Diabetologia, 2011;Liu et al., Cell Res, 2014)。2022年,邓宏魁课题组开创了人体细胞化学重编程技术(chemical reprogramming),仅使用外源化学小分子就可以将终末分化的体细胞逆转至胚胎发育早期的多能干细胞,这种化学重编程获得的人多能干细胞称为人CiPS细胞(human chemical induced pluripotent stem cells)(Guan et al., Nature, 2022)。利用人CiPS细胞,邓宏魁课题组大幅改进了人多能干细胞向胰岛细胞的分化方案,并将人多能干细胞分化的胰岛细胞移植入非人灵长类糖尿病动物模型,系统评价了其治疗糖尿病的安全性和有效性(Du et al., Nature Medicine, 2022;Liang et al., Nature Metabolism, 2023),为开展临床试验奠定了基础。本研究发现的促进胰岛β细胞功能成熟的方案,将帮助领域在体外更有效的制备功能成熟的人多能干细胞衍生胰岛细胞,为未来临床细胞替代治疗糖尿病提供更高质量的分化胰岛细胞。
邓宏魁课题组滑慧娟博士、李程课题组博士研究生王雅琦,邓宏魁课题技术员王小丰为本文的共同第一作者。本研究得到了北京大学汤超教授团队、天津第一中心医院沈中阳教授和王树森教授团队的大力支持。
原文链接:https://www.cell.com/cell-stem-cell/fulltext/S1934-5909(24)00137-1