检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
蛋白质磷酸化是细胞中重要的调控方式,而这一机制的发现很大程度上源于Edmond Fischer和Edwin Krebs对糖原磷酸化酶的研究1-3。糖原是动物细胞内葡萄糖的储备库;糖原磷酸化酶催化糖原分解为葡萄糖,是糖原降解的限速酶,其活性受到严格的调控。磷酸化酶激酶PhK催化糖原磷酸化酶发生磷酸化,将其从低活性的b形式转化为高活性的a形式。这种磷酸化介导的调节机制的发现不仅拓宽了人们对能量代谢过程的认识,还改变了对细胞信号传导的理解,是生物化学领域的重要里程碑。
PhK是第一个被纯化的蛋白激酶,也是最大、最复杂的蛋白激酶之一,总分子量为1.3兆道尔顿。它包含α、β、γ和δ四个亚基。其中,α和β亚基是结构亚基;γ亚基具有激酶活性,由一个持续激活的N端激酶结构域(KD)和一个C端调节结构域(CRD)组成;δ亚基为钙调蛋白,但其特殊之处在于无论Ca2+是否存在,δ亚基都能紧密结合在PhK中,作为其不可或缺的组成部分4,5。Ca2+可能通过与钙调蛋白结合产生的构象变化激活PhK。尽管关于PhK的研究已经持续近70年,但其具体的组装方式和激活的分子机理仍不完全清楚。2024年3月28日,肖俊宇课题组在Nature Communications期刊发表题为“Architecture and activation of human muscle phosphorylase kinase”的论文,揭示了PhK全酶的组装和激酶活性自抑制机制,并提出了PhK的Ca2+激活模型。
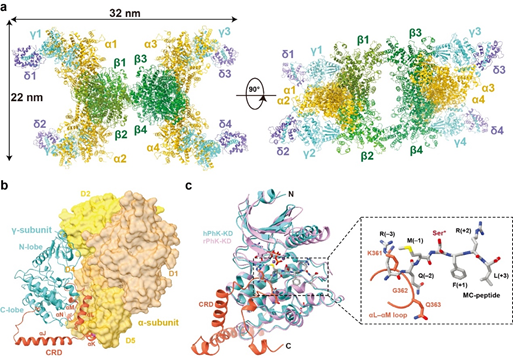
图1. PhK全酶的组装和激酶活性自抑制
PhK由α、β、γ和δ四个亚基组装成α4β4γ4δ4十六聚体(图1a)。β亚基和α亚基位于复合体的中心,为十六聚体的组装骨架。其中,2个β亚基和2个α亚基以广泛的相互作用形成α2β2 亚复合体; 2个α2β2再经由β亚基C端形成的桥相互连接。行使激酶活性的γ亚基通过与α亚基的相互作用组装到全酶上。δ亚基则牢牢结合在γ亚基CRD中的疏水螺旋αJ上,同时与KD也存在相互作用。γ亚基与α亚基之间的相互作用对其激酶活性的自抑制尤为重要。γ亚基KD的N-lobe和C-lobe分别连接α亚基D2和D5结构域,使得γ亚基以催化口袋朝内的方式扣在α亚基上。同时,γ亚基的自抑制结构域(AID)以广泛的疏水相互作用夹在C-lobe与α亚基D5结构域之间,且AID中Lys361-Gln363占据了底物肽段的结合位置,通过“假底物”竞争抑制的机制实现了激酶活性的自抑制(图1b,c)。该研究也进一步解析了PhK在Ca2+激活状态的结构,并提出了Ca2+激活PhK的分模型:在接受到Ca2+信号后,δ亚基首先会与Ca2+结合并发生构象变化;δ亚基的构象变化传导至AID与KD C-lobe的相互作用界面并将其打破,引起激酶活性自抑制的解除(图2)。
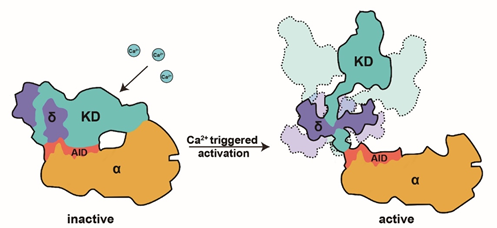
图2. PhK的Ca2+激活模型
总之,该研究基于高分辨率的结构揭示了人源肌肉亚型PhK全酶的组装机制,并提出了Ca2+激活模型,为深入研究这一重要激酶复合物的功能奠定了理论依据和结构基础。
蛋白质与植物基因研究国家重点实验室、bat365中文官网登录入口、北大清华生命科学联合中心肖俊宇教授为该论文的通讯作者。bat365中文官网登录入口2018级博士生杨晓珂和2021级博士生朱铭淇为该论文的共同第一作者。昌平实验室2022级博士生卢雪和北京大学博雅博士后王禹心为该论文提供了帮助。
原文链接:https://www.nature.com/articles/s41467-024-47049-2
参考文献:
1. Krebs, E. G. Protein phosphorylation and cellular regulation I (Nobel Lecture). Angew. Chem. Int. Ed. Engl. 32, 1122–1129 (1993).
2. Fischer, E. H. Protein phosphorylation and cellular regulation II (Nobel Lecture). Angew. Chem. Int. Ed. Engl. 32, 1130–1137 (1993).
3. Fischer, E. H. & Krebs, E. G. Conversion of phosphorylase b to phosphorylase a in muscle extracts. J. Biol. Chem. 216, 121–132 (1955).
4. Vénien-Bryan, C. et al. The structure of phosphorylase kinase holoenzyme at 9.9 Å resolution and location of the catalytic subunit and the substrate glycogen phosphorylase. Structure 17, 117–127 (2009).
5. Cohen, P. et al. Identification of the Ca2+-dependent modulator protein as the fourth subunit of rabbit skeletal muscle phosphorylase kinase. FEBS Lett. 92, 287–293 (1978).