检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
哺乳动物的发育和细胞命运决定是生物学的核心研究问题之一。哺乳动物的生命起源于受精卵,通过发育过程分化为数百种不同类型的细胞,形成生物个体。细胞分化和命运决定依赖于复杂和动态的基因调控。近年来的研究发现,细胞核内的DNA通过折叠和压缩形成染色质高级结构,染色质高级结构参与基因的转录调控。不同类型的细胞具有特异的染色质高级结构,但是它们如何形成的机制和功能尚不完全清楚。2022年朱大海/张勇团队首次报道了经典骨骼肌特异的先锋转录因子MyoD作为3D基因组组织者在建立和维持骨骼肌干细胞特异染色质高级结构中的新功能(Wang et al. Nature Communications 2022)。而CTCF作为关键染色质架构蛋白,与染色质高级结构的建立和维持密切相关。以往研究表明,CTCF的缺失会导致多种细胞分化和组织发育缺陷,包括影响记忆和学习能力、心血管发育、血液细胞分化以及肢端发育等。然而,在各种组织中普遍表达的CTCF如何通过建立细胞谱系特异染色质高级结构调控决定细胞命运基因表达的分子机制尚不清楚。
2023年10月17日,中国医学科学院基础医学研究所张勇教授、广州生物岛实验室朱大海教授和北京大学生命学院李程研究员研究组合作,在《Cell Reports》期刊上发表了"CTCF coordinates cell fate specification via orchestrating regulatory hubs with pioneer transcription factors"的研究论文。研究人员利用多组学测序、CTCF/MyoD基因敲除的小鼠模型、CTCF结合位点的基因编辑以及CRISPR成像技术,在骨骼肌分化和再生系统中深入研究了CTCF在细胞命运决定中的分子机制。研究表明,CTCF与细胞类型特异的先锋转录因子(pioneer transcription factor)协同形成染色质互作枢纽,共同调控谱系特异下游基因的表达,从而决定细胞分化的命运。
研究者首先利用已发表的人和小鼠原位肝脏细胞、骨骼肌细胞和B细胞的公共组学数据进行数据挖掘。通过整合分析CTCF结合、基因表达和染色质高级结构组学数据,发现CTCF在染色质的结合位点分为细胞类型保守位点和细胞类型特异位点,后者与谱系特异的先锋转因子共定位。这些谱系特异CTCF结合位点也富集在谱系特异的调控元件如超级增强子(super enhancer)和染色质环锚点(chromatin loop anchor),提示它们参与谱系特异功能基因的表达调控。
为了研究谱系特异先锋因子参与调控CTCF与染色质结合的机制,研究者利用骨骼肌谱系转录因子MyoD敲除小鼠,发现MyoD敲除导致骨骼肌细胞特异的CTCF结合位点信号减弱,并伴随着这些位点染色质开放性的下降。与此相反,细胞类型保守的CTCF结合位点和染色质开放性不受MyoD敲除的影响。在肝脏细胞和B细胞中也观察到谱系特异的CTCF结合与染色质的开放性呈正相关。这些结果提示先锋转录因子通过增加染色质开放性,协助CTCF结合在谱系特异的调控元件处。
为了研究谱系特异的CTCF结合在染色质结构和基因表达调控中的作用,研究者利用CRISPR成像分别观察MyoD敲除和CTCF结合改变对骨骼肌分化的关键基因Actc1调控的影响。在MyoD敲除的小鼠中,MyoD/CTCF共同结合形成的Actc1位点染色质互作枢纽相关的启动子、增强子之间的空间距离显著变远,而回补MyoD的表达恢复了这些位点之间的距离。敲除或者阻滞在Actc1位点附近的CTCF结合位点序列也破坏了染色质互作枢纽的紧密性,伴随着Actc1基因表达下降。这些结果表明, CTCF通过形成谱系特异的染色质互作枢纽参与调控谱系功能基因的转录调控。
最后,作者使用CTCF敲除小鼠探索了CTCF对骨骼肌分化和再生的影响。结果表明在骨骼肌干细胞中特异性敲除CTCF后,骨骼肌干细胞分化基因表达下调,骨骼肌干细胞分化能力减弱,小鼠骨骼肌再生能力明显下降而无法修复损伤的肌纤维。这些结果表明CTCF在骨骼肌干细胞的分化和再生过程中发挥着十分重要的作用。
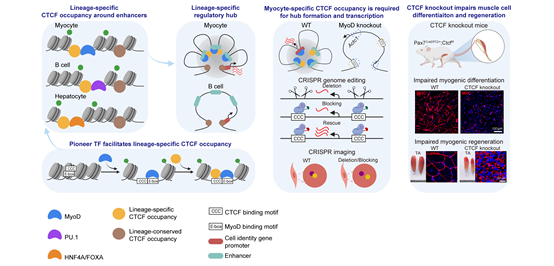
图1:CTCF和先锋因子协同形成染色质互作枢纽,决定细胞分化和命运
综上,该研究利用生物信息数据挖掘和体内外功能实验验证,揭示了染色质架构蛋白CTCF作为细胞命运决定cofactor协助谱系特异先锋转录因子调控细胞命运决定基因表达,参与细胞命运决定的分子机制(图1), 更重要的是生物信息分析提示该机制可能在哺乳动物多个细胞谱系中普遍存在。因此,本研究结果为深入理解和进一步扩展CTCF与谱系特异先锋因子相互作用形成regulatory hub调控细胞命运的普遍生物学意义具有启示作用。
bat365中文官网登录入口博士生刘玉婷(现耶鲁大学博士后)、中国医学科学院基础医学研究所博士生万鑫、广州实验室副研究员李虎博士为论文的共同第一作者。中国医学科学院基础医学研究所张勇教授、广州生物岛实验室朱大海教授、bat365中文官网登录入口李程研究员是论文的共同通讯作者。军事医学研究院陈河兵副研究员和北京大学季雄研究员为该研究提供了重要帮助。
论文链接:https://linkinghub.elsevier.com/retrieve/pii/S2211124723012718
李程研究组介绍:http://3d-genome.life/