检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2023年6月20日,北京大学高宁教授课题组在Cell Discovery上发表了题为“Structural and mechanistic insights into the DNA glycosylase AAG-mediated base excision in nucleosome”的研究论文。论文利用冷冻电镜技术阐明了DNA糖基化酶(DNA glycosylase)在核小体(Nucleosome core particle,NCP)不同位置上的碱基切除机制。
真核生物的碱基切除修复(Base excision repair,BER)可以定位和修复染色质中的DNA损伤。基因组DNA中含有大量外源损伤剂诱导和自发分解反应造成的DNA碱基损伤。DNA糖基化酶可以识别并切除损伤的DNA碱基,生成一个无嘌呤/无嘧啶的位点(AP site),这个位点可以被核酸内切酶APE1切割并在DNA上产生一个缺口。随后的修复过程可以通过DNA聚合酶、DNA连接酶以及相关蛋白质因子通过两种途径修复(Short-patch and long-patch BER pathways)。
烷基腺嘌呤DNA糖基化酶AAG (3-methyladenine DNA glycosylase)可以识别包括3-甲基腺嘌呤(3-methyladenine,3-MA),7-甲基鸟嘌呤(7-methylguanine,m7G),氧化腺嘌呤1,N6-乙醇腺嘌呤(1,N6-ethenoadenine, εA)和脱氨腺嘌呤次黄嘌呤(Hypoxanthine)在内的碱基损伤。在人类中,AAG的表达改变与微卫星不稳定性、自发移码突变和多种癌症有关。在小鼠模型中,AAG敲除小鼠容易发生肝癌和结肠直肠癌,而在AAG过表达的小鼠中,过度的AAG活性会导致肝毒性、致死和其他烷基化诱导毒性。
DNA的碱基损伤可以发生在染色质化的真核生物基因组的所有区域,包括核小体DNA位点。核小体作为天然的屏障会阻碍BER相关蛋白对损伤位点的接触,只有一部分面向溶剂侧的DNA自由暴露。广泛的体外研究表明,BER因子可以选择性地定位并结合到核小体中的不同损伤位点。一般来说,AAG在某一位点的活性和该位点的可接触性正相关,研究证实与组蛋白核心区域相互接触的DNA具有更高的突变率,这可能由于BER因子与损伤碱基低的接触性密不可分。在结构上,损伤碱基的可接触性取决于其在核小体上的平移位置和旋转方向,面对溶剂的损伤碱基确实比封闭和嵌入的损伤碱基更容易被修复。以往的结构研究主要聚焦在DNA糖基化酶对于裸露DNA上的修复机制,但这些蛋白质如何克服核小体施加的障碍来定位和修复核小体中的DNA碱基损伤尚不完全清楚。本研究将模拟损伤的碱基(Deoxyinosine, DI)设计在核小体DNA的不同位置上,包括不同的超螺旋(Superhelical locations, SHLs)和旋转方向上(图1a),这些位置分别代表了不同的SHLs上相似性的位置(-30,-50)和同一个SHL上不同旋转方向上导致的溶剂可及性不同的位置,包括完全暴露(-50),封闭(-53)和嵌入(-55)的位置上。通过冷冻电镜技术分别解析了四种包含损伤碱基的核小体结构(Apo-state)以及核小体和DNA糖基化酶AAG的复合物结构(Post-catalytic state)。
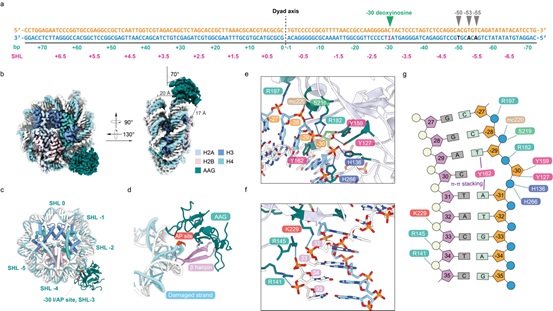
图1 AAG-NCP-30AP复合物示意图
结构分析表明在线性或者核小体DNA底物上,AAG都使用一组同样的保守氨基酸残基进行相互作用,并且作用模式比较相似(图1b-g)。重要的是,通过与不包含DI的NCP结构比较,作者发现仅存在一个DI核苷酸就足以全面扰动核小体DNA的结构,导致核小体DNA和组蛋白核心之间的包埋表面积减少,并且无论受损碱基的位置如何,这些核小体DNA的整体扰动都处于相似的模式:由DI引起的DNA形变在核小体DNA出口附近最为明显。
进一步的结构分析发现,在形成的稳定AAG-NCP复合物中(包括-30,-50,-53),NCP的损伤位点都已变成了AP site,处于催化后状态(post-catalytic state)。在这些AAG-NCPAP复合物中,AAG的结合导致受损碱基周围的核小体DNA发生非常显著但相对局部的扭曲,根据受损部位的平移和旋转位置,AAG利用不同的机制接触损伤的碱基。(1)对于具有高溶剂可及性的完全暴露的DNA损伤碱基,AAG具有很高活性,能直接接触这些损伤碱基,在结构上直接增加DNA的局部扭曲以识别损伤位点(图2a)。(2)对于具有中等溶剂可及性的封闭的DNA损伤碱基,AAG的活性相比于完全暴露位置的AAG活性低,AAG诱发剧烈的局部的DNA扭曲,并且为了接触到修复碱基,还需要DNA的旋转和包含约1 bp的位移去缓解核小体的造成空间障碍(图2b)。(3)对于溶剂可及性极低的深埋位置的DNA损伤碱基,局部DNA扭曲和有限的核小体DNA位移不足以完全暴露埋藏的碱基。此时,被DI整体扰动的核小体可能更容易自发展开(nucleosome breathing),AAG可以利用这一特性来捕获分离的末端dsDNA并使这一过程不轻易可逆。因此,在这些完全深埋的位点中,核小体DNA的部分开放可能是AAG的招募和催化的先决条件(图2c)。
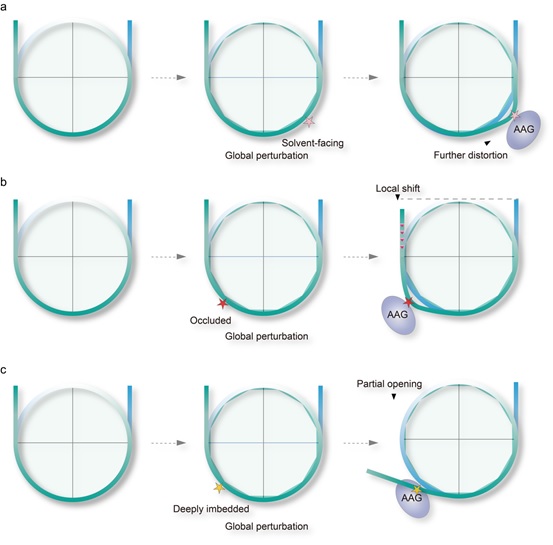
图2 AAG介导的核小体碱基切除的示意图
综上所述,本研究解析了包含不同位置损伤的核小体结构以及核小体和DNA糖基化酶AAG的结构,揭示了碱基损伤对核小体稳定性的影响,为理解DNA糖基化酶AAG如何利用核小体的结构动力学参与核小体中的DNA碱基损伤修复提供了一个机制框架。在更广泛的背景下,这些数据也有助于理解其它的DNA结合蛋白如何调控核小体的结构动力学来发挥其分子功能。
bat365中文官网登录入口高宁教授为本文的通讯作者。高宁实验室的郑吕钦(已毕业)和蔡斌(已毕业)为本文的共同第一作者。bat365中文官网登录入口的李晴教授提供了本实验所需的爪蟾组蛋白的质粒。本研究得到了国家重点研发计划、生命联合中心、膜生物学国家重点实验室和bat365中文官网登录入口启东产业创新基金的经费支持,以及冷冻电镜平台、北京大学电镜实验室、高性能计算中心、生科院仪器中心及凤凰工程的技术支持。
文章链接:https://www.nature.com/articles/s41421-023-00560-0