检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
三磷酸腺苷(ATP)、二磷酸腺苷(ADP)、腺苷(Adenosine,Ado)等嘌呤类分子细胞内外广泛存在。胞内的嘌呤类分子主要负责调控细胞能量代谢等过程;而胞外的嘌呤类分子则作为信号分子(被称为“嘌呤类递质”),通过作用在其相应受体调节呼吸调控、味觉感受、睡眠等生理活动;嘌呤类递质及其受体还参与调节癫痫、疼痛、炎症反应、脑外伤和缺血等病理状态。此外,嘌呤能信号失调还与抑郁、精神分裂症等精神类疾病密切相关。迄今,解密嘌呤能信号传递功能的一大技术瓶颈是缺乏灵敏、特异且非侵入性的工具,以高时空分辨率地报告嘌呤类递质的动态变化。
2021年12月22日,北京大学李毓龙实验室在Neuron杂志在线发表了题为A sensitive GRAB sensor for detecting extracellular ATP in vitro and in vivo的研究论文,报道了新型基因编码的ATP探针GRABATP1.0的开发和在体外及活体动物的应用。李毓龙实验室自2018年以来,先后开发了针对乙酰胆碱、多巴胺、去甲肾上腺素、腺苷、五羟色胺、内源大麻素等神经递质或调质的荧光探针,此次发表的GRABATP1.0是其又一力作,进一步扩展了GRAB系列荧光探针家族。

在这一工作中,李毓龙实验室运用其先前设计的GRAB探针策略(GPCR Activation-Based sensor),基于人源ATP受体P2Y1和循环重排的绿色荧光蛋白cpEGFP开发了ATP探针GRABATP1.0(简称为ATP1.0)。在体外培养的HEK293T细胞、原代神经元及星形胶质细胞中,ATP1.0探针均表现出优异的细胞膜定位。神经元表达的ATP1.0对外源加入的ATP及ADP有~780%的信号响应、~80 nM的亲和力(EC50),及高度的分子特异性(图1)。此外,ATP1.0能够在亚秒级别响应胞外ATP浓度的变化。
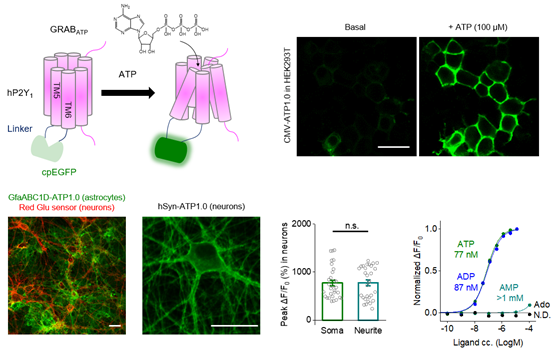
图1:ATP1.0在HEK293T细胞、星形胶质细胞及神经元上的表现
ATP1.0探针能否用来检测内源释放的ATP呢?作者从原代培养的海马细胞入手,发现ATP1.0能够检测到机械刺激及低渗透压刺激引发的ATP释放,药理学实验及突变型探针实验进一步验证了ATP1.0检测信号的特异性(图2)。有意思的是,在不给予额外刺激时,ATP1.0也能灵敏地记录到直径约为30微米的自发性ATP释放事件,表明ATP的释放具有化学分子特异和空间特异性。
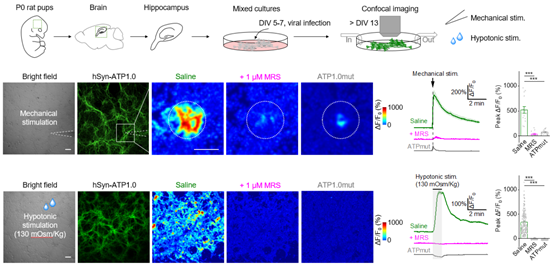
图2:ATP1.0在原代培养的海马细胞中检测内源ATP的释放
ATP1.0探针能否在活体动物加以运用呢?过去的研究发现,当细胞受到损伤时,胞内毫摩尔级别的ATP被释放胞外,作为“危险信号”被周围的胶质细胞感受,从而激活小胶质细胞释放趋化因子等,产生免疫反应。胶质细胞上表达的嘌呤类受体在小胶质细胞激活、迁移及分泌信号因子过程中发挥重要作用。那么,在这一过程中,信号分子ATP的传播和小胶质细胞的迁移是如何动态并变化的?作者将ATP1.0探针表达在斑马鱼中,通过激光照射引发局部损伤时发现ATP的释放呈现“波状”传播;通过将绿色ATP1.0探针表达在红色荧光蛋白标记小胶质细胞的转基因斑马鱼中,能够直观地检测到随着ATP信号的传播小胶质细胞的迁移过程(图3上)。
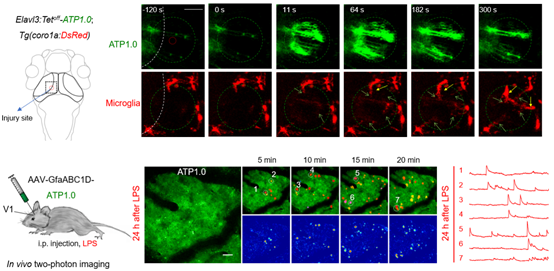
图3:ATP1.0报告斑马鱼受到局部损伤时及小鼠发生免疫反应时大脑中的胞外ATP信号
当大脑处于疾病状态时,ATP的释放又会呈现什么样的变化?如上所述,嘌呤能信号在免疫中扮演着重要角色。为了检测免疫反应过程中大脑中ATP信号的变化,作者通过腹腔注射脂多糖(Lipopolysaccharide,LPS)的方式引发小鼠的系统性免疫反应,同时通过AAV病毒介导的方法将ATP1.0表达在小鼠的大脑皮层,并借助双光子成像记录ATP的信号。有意思的是,LPS注射后,小鼠大脑皮层呈现出强烈、但空间特异的ATP信号上升现象(见视频)。
视频:腹腔注射LPS的小鼠炎症模型中大脑皮层ATP信号的变化,注意局部ATP释放的信号
除了开发高灵敏的ATP1.0探针外,作者还开发了反应动力学更快及亲和力更低的ATP探针ATP1.0-L。在神经元中表达的ATP1.0-L对胞外的ATP的亲和力(EC50)约为32 μM。当在原代培养的海马细胞及活体的斑马鱼中表达,ATP1.0-L均能检测到更加局部的ATP信号。
综上所述,在这项工作中作者开发了新型遗传编码的ATP荧光探针,实现了对胞外ATP的高时空分辨率的记录。在此之前,李毓龙课题组在2020年还开发了另外一种嘌呤类递质腺苷的GRAB荧光探针,并助力中国科学院脑科学与智能技术卓越创新中心徐敏团队在睡眠调控中的研究。相信一系列新型成像工具的开发,将助力科学家更加深入地研究嘌呤能信号传递在生理和病理条件下的功能和调控机理。
bat365中文官网登录入口博士后武照伐为本文第一作者,李毓龙教授和武照伐博士为共同通讯作者,本科毕业生何凯凯、博士研究生潘孙磊、李柏翰、邓飞和王欢等对文章做出了重要贡献。该工作得到了北京脑科学与类脑研究中心井淼团队(陈阅、席凤雪)及中国科学院脑科学与智能技术卓越创新中心杜久林团队(李红羽、刘亭亭)等的通力合作,并得到了北京大学膜生物学国家重点实验室、北大-清华生命科学联合中心、国家自然科学基金、北京市科委、峰基金及勃林格殷格翰博士后奖学金等机构和经费的大力支持。
原文链接:https://doi.org/10.1016/j.neuron.2021.11.027
更多李毓龙实验室工作详见:http://yulonglilab.org/;此外,李毓龙实验室诚聘不同学科背景的副研究员、博士后以及科研助理,待遇从优,欢迎对脑科学感兴趣的有志青年加入。